小分子化合物(SMCs)平均分子质量小于5000 Da,在免疫化学中被归类为半抗原。SMCs指的是内源性化合物(如激素),外源性药物(如药物),或自然和人工环境污染物(如真菌毒素或农药)。从环境和食品安全监测到临床诊断,监测SMCs需要使用快速和灵敏的监测技术,以确保最大疗效和相关性。越来越多研究涉及SMC监测方法,如HPLC(高效液相色谱),GC(气相色谱),LC-MS/MS(液相色谱-串联质谱),SPR(表面等离子体共振)和其他相关技术。虽然这些方法具有很高的灵敏度和特异性,但由于样品前处理耗时且复杂,设备昂贵以及需要受过专业培训的技术人员,不适用于现场快速检测。基于抗原-抗体特异性结合的免疫化学分析(ICAs)具有价格低廉、操作简单、通量高、检测快速等优点。因此,ICAs不仅在前沿研究中非常突出,还能应用于相关现场检测。
ICAs有两种反应模式:竞争和非竞争(图1)。在某些情况下,SMCs可能受到大小或结构的限制,只具有一个合适的免疫结合位点,为单表位抗原。竞争ICA反应模式最适合这些靶标SMCs。靶标分析物将与标记的半抗原竞争结合固定浓度的抗体。当该反应达到平衡时,去除游离半抗原,并监测特异性结合产生的信号,其与靶标分析物浓度成反比。竞争免疫分析法的灵敏度受到抗原抗体亲和力的限制,当亲和常数(Ka)大于10-12mol/L时,灵敏度可达到10-12mol/L水平。但抗体的亲和常数(Ka)通常小于1010 mol/L,因此,竞争性ICA往往表现出相对较低的灵敏度,使得在靶标浓度非常低的情况下很难区分阴性和阳性样品,难以满足污染物检测的基本应用需求。这种模式在靶标低浓度情况下也会产生较大的误差,导致准确度、重复性、灵敏度和线性范围较差。
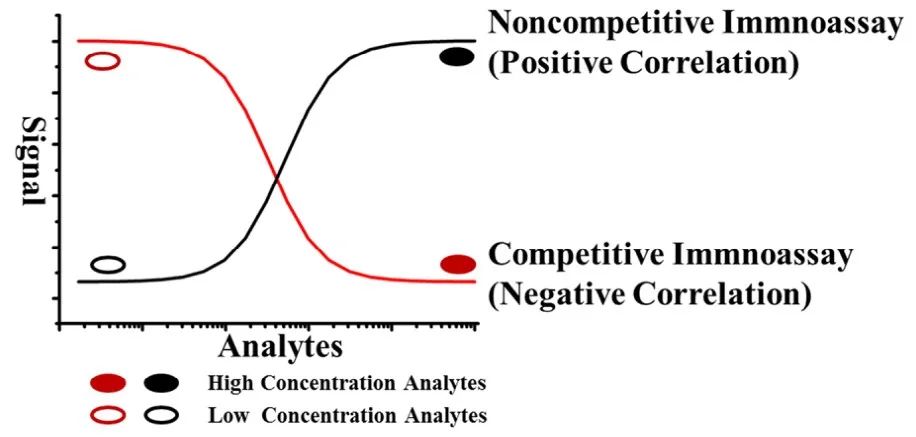
图1 竞争性与非竞争性免疫分析的差异
另一方面,非竞争性ICA通常应用于具有多表位的大分子抗原的检测,常用的非竞争性免疫分析法是夹心ELISA。在夹心ELISA过程中,使用两种不同的抗体在靶标分子周围形成夹心,其中一种抗体捕获靶标(捕获抗体),另一种抗体被标记(检测抗体),能够产生与靶标物浓度成正比的信号。在非竞争性ICA中,抗原必须是具有多个表位的多价抗原,以便能够同时与捕获抗体和检测抗体结合。
用于监测SMCs的有效非竞争性ICAs的设计依赖于对关键试剂的适当选择,如抗体、吸附性载体材料、特异性半抗原标记物。多克隆抗体和单克隆抗体虽然供应丰富且种类繁多,但也表现出了一些缺点,有时灵敏度、亲和力、稳定性或种属特异的识别特征不能满足应用需求。为了解决这些问题,通过新的生物识别材料(如受体蛋白、重组抗体和适配体)拓宽了该平台的能力。此外,ICA平台已经开始广泛应用新的标记,如镧系螯合物、量子点(QDs)和DNA测序,使ICA平台用于SMCs非竞争性检测具有可行性。
由于这些新技术具有更宽的检测范围、更高的灵敏度及易于自动化的显著优势,因此研究人员专注于开发SMCs的非竞争性分析。迄今为止,基于化学修饰半抗原和专用分离设备、新型抗体以及其他相关技术的非竞争性反应模式的相关报道较多。本文综述了六种用于检测SMCs的非竞争性反应设计:基于生物素-亲和素系统的双表位夹心非竞争性免疫分析(BA-NIA)、基于固相固定化表位的非竞争性免疫分析(SPIE–NIA)、基于抗独特型抗体的非竞争性免疫分析(AIA–NIA)、基于抗免疫复合物抗体的非竞争性免疫分析(AICA-NIA)、开放式夹心非竞争性免疫分析(OS-NIA)和基于标记分析物抗体置换的非竞争性免疫分析(DLA-NIA)。综述了六种设计方法的基本原理和应用现状。
1.基于生物素-亲和素系统的双表位夹心非竞争性免疫分析(BA-NIA)
BA-NIA技术由Ishikawa首先提出并应用于小分子多肽。由于SMCs的表位单一,传统的双位点ICAs无法检测。这种非竞争性设计依赖于使用强亲和系统,即生物素-亲和素复合物,与分析物共价连接来获得两个位点的免疫检测。检测原理是用适当的物质标记待测半抗原,修饰的半抗原可以同时结合标记识别元件和抗体,从而实现双位点非竞争性分析。具体来说,靶标分析物被生物素化,能够配对结合形成复合物,例如固相吸附的亲和素类似物和可检测的标记抗体。这样,SMCs可以通过夹心非竞争性免疫分析法进行检测。具体反应步骤如下(图2):1)将靶标分析物与生物素结合,从而产生一个体积更大的复合物,该复合物也具有第二个表位。2)生物素化分析物经免疫亲和柱纯化后与标记抗体混合。3)将混合物转入预包被亲和素的酶标板,进行夹心非竞争性反应。4)最后,记录信号强度,观察到信号强度与靶标分析物浓度呈正相关。

图2 生物素亲和素体系双表位夹心非竞争性免疫分析方案
Ishikawa首次用血管紧张素I证明了这一原理的可行性,血管紧张素I是一种由10个氨基酸组成的单链肽,也可归为小分子半抗原。将血管紧张素I生物素化,然后用抗血管紧张素I Fab'-HRP偶联物和链霉亲和素包被聚苯乙烯微球进行夹心反应模式。血管紧张素I的检测限(LOD)为10 amol(13 fg),比使用相同抗体的ICA应用低100倍。在另一篇文章中,描述了一种应用这种设计来检测血浆中精氨酸加压素类似结构的免疫分析法。LOD为11 fg(10 amol),比使用相同抗血清的竞争性测定低45倍。符合SMC半抗原的氨基也可以通过L-甲状腺素(T4)实验进行检测,将T4生物素化,并通过应用这种设计进行检测,使灵敏度增加50倍,LOD为78 fg(0.1 fmol)/管。根据之前的报道,在BA-NIA平台上开发和优化了高灵敏度、非竞争性的ICA。通过免疫复合物形成过程中反复靶向结合反应,可显著减少非特异性信号。此外,靶标分析物在选择性结合步骤中富集,提高了灵敏度。[Arg8]-加压素(AVP)是另一种SMC,采用非竞争性免疫分析法检测。将AVP生物素化,并与2,4-二硝基苯荧光素二硫-BSA-兔抗AVP IgG偶联物反应。荧光法测定结果,LOD为1.1 fg(1 amol)/管。在另一实验中,采用BA-NIA设计检测血浆中α-人心房钠肽(α-hANP)。α-hANP被生物素化,并与IgG涂层的聚苯乙烯微球结合。经洗涤后,该复合物与2,4-二硝基苯荧光素-BSA-二硫化物-兔抗α-hANP IgG偶联物反应。该复合物被进一步捕获在IgG包被的聚苯乙烯微球上,与亲和素-β-D-半乳糖苷酶偶联反应。然后,将复合物依次转移到抗荧光素IgG包被聚苯乙烯微球和IgG(抗兔IgG)包被聚苯乙烯微球上。最后,经过4次洗涤以减少干扰并浓缩分析物,荧光法测定结果,LOD为3 fg(1 amol)/管。在这个BA-NIA过程中,生物体液中蛋白质和其他基质的干扰可以通过使用分子筛从蛋白质中分离分析物来消除。BA-NIA方案可适用于半抗原(包括多肽)的测定,这些半抗原可被衍生化,从而同时被抗半抗原抗体和亲和素分子结合。该BA-NIA方法灵敏度高,可用于SMCs的夹心免疫检测。
2.固相固定表位非竞争性免疫分析(SPIE-NIA)
SPIE-NIA最初由Pradelles提出用于SMC。这种非竞争性多步骤程序基于捕获抗体和检测抗体相继识别的单个表位,涉及分析物与固相的共价交联;原理示意图如图3所示。
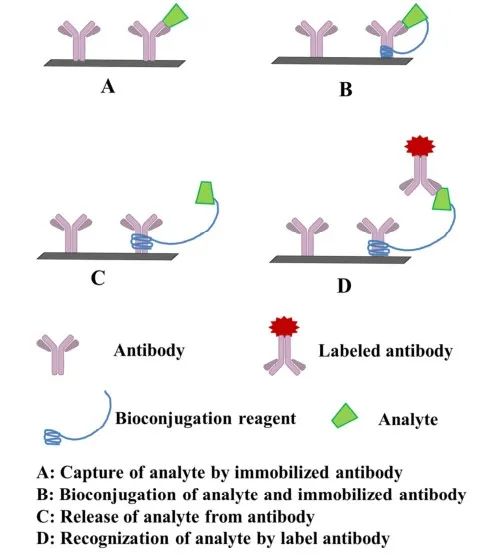
图3 基于固相固定化表位的非竞争性免疫分析方案
在这种方法中,固定化抗体和标记抗体可以是相同的。因此,在这种夹心结构中,无需筛选可以结合分析物不同表位的不同抗体。具体方法如下:1)用固定化抗体捕获半抗原分析物(标准物或样品)。2)用双功能试剂将半抗原中的氨基或其他基团(如戊二醛、次酸二丁二酰亚咪酯、羰基二咪唑等)生物偶联到固定化抗体上。3)生物偶联后,通过酸性、碱性或有机溶剂处理,使半抗原分析物在变性条件下从固定化抗体中释放出来。因此,表位被释放,半抗原被释放到溶剂中。4)释放的半抗原通过共价键与固定化抗体结合。释放的表位可以被酶标抗体重新识别。通过酶活性监测结果。在对SMCs的SPIE-NIA的初步研究中,主要关注具有活性氨基的SMCs,这些氨基可以与固定化抗体进行生物偶联。Pradelles报道了一种新的基于酶的免疫测定方法,可以测定三种含有伯氨基的小半抗原(甲状腺素,MW 777;物质P,MW 1347;内皮素,MW 2492)。戊二醛和二丁二酰亚酯作为同双官能团试剂。这些分析物的LOD为4-10 fmoL/mL,比传统的竞争ICAs灵敏度高70-200倍。白三烯C4(L TC4)有一个活性氨基,SPIE-NIA采用戊二醛交联生物偶联法检测LTC4,LOD为2 pg/mL。将SPIE-NIA设计应用于血管紧张素II,获得的结果灵敏可靠,LOD为0.5 pg/ml,CV值在2-100 pg/ml范围内低于15%。上述方法主要依赖于单克隆抗体,而多克隆抗体也适用于SPIE-NIA。一种应用于七肽BN 52080的SPIE-NIA使用多克隆抗体进行检测,肽首先与吸附到固相的多克隆抗体免疫结合。然后,进行共价固定,使用NaOH使戊二醛从抗体结合部位释放。与固相相连的肽进一步用由亲和层析纯化的与乙酰胆碱酯酶偶联的相同抗体组成的示踪剂定量。该方法的检出限为10 pg/mL,比使用相同抗体的酶免疫法灵敏度高5倍。如前所述,这些是基于氨基使用化学或生化试剂进行交联的新型SPIE-NIA。对于不含氨基的分析物,生物偶联需要一个预衍生化步骤。在SPIE-NIA监测无氨基的甲状腺素(TRH)时,首先用重氮APEA衍生标准TRH或生物样品,引入活性基团。然后使用乙酰胆碱酯酶标记的TRH单克隆抗体对靶标分析物进行监测,LOD为0.1 pmoL/mL,灵敏度提高了26倍。除了化学和生化偶联外,紫外线辐射也被报道为偶联的另一种方法。在l-甲状腺素SPIE-NIA的开发过程中,l-甲状腺素被紫外直接光活化,与结合蛋白形成共价交联。该技术进一步成功应用于L-甲状腺素的检测。经紫外线照射和甲醇处理后,用乙酰胆碱酯酶标记的抗L-甲状腺素抗体检测共价连接的L-甲状腺素,LOD为4.8 nmol/L。然而,本研究表明,在共价光交联过程中,靶标的氨基参与了反应。文献中也报道了直接紫外线照射不含氨基的半抗原:使用紫外线照射将17-雌二醇直接交联到抗体上。交联效率与辐照能量和波长直接相关。该检测特异性好(与其他天然类固醇无交叉反应)、准确度高、灵敏度高(人血清LOD为38 pg/mL)。光交联是一个复杂的步骤,不同的反应体系可能会产生不同的结果。自由基倾向于与周围环境发生反应,这可能导致零长度交联。羟基自由基(OH•)被认为是一种强大的原子抽提剂。OH•是用Fenton亚铁(Fe2+)试剂原位制备的,它促进了photo-SPIE-NIA的交联。其他过渡金属,如Cu2+,也被用来通过Fenton化学生成自由基。利用类Fenton反应产生的自由基,开发了一种新的SPIE-NIA程序(SPIE-Rad)。该方法成功应用于17-β-雌二醇,以抗雌二醇单克隆抗体为捕获抗体,与fenton类试剂交联,在人血清中LOD为5 ng/L。
3.基于抗独特型抗体的非竞争性免疫分析(AIA-NIA)
AIA-NIA最早是由Kohen团队提出的。这种抗独特型抗体(Ab2)可以结合抗体(Ab1)可变区的抗原决定簇。不同的结合亲和力取决于重链(VH)和轻链(VL)可变区的氨基酸序列。抗独特型抗体有Ab2α和Ab2β两种。Ab2α可以结合抗体可变区框架区,该可变区距离Ab1的结合位点相对较远;这并不影响Ab1与抗原的结合。Ab2β可结合在Ab1与抗原复合物的位置附近,有效阻断Ab1对抗原的识别。AIA-NIA原理如图4所示。3)加入标记的Ab2α可捕获Ab1/抗原复合物,而Ab2α由于空间位阻不能捕获Ab2β/Ab1复合物。4)根据与Ab1/抗原复合物结合的标记Ab2α的数量监测信号强度。
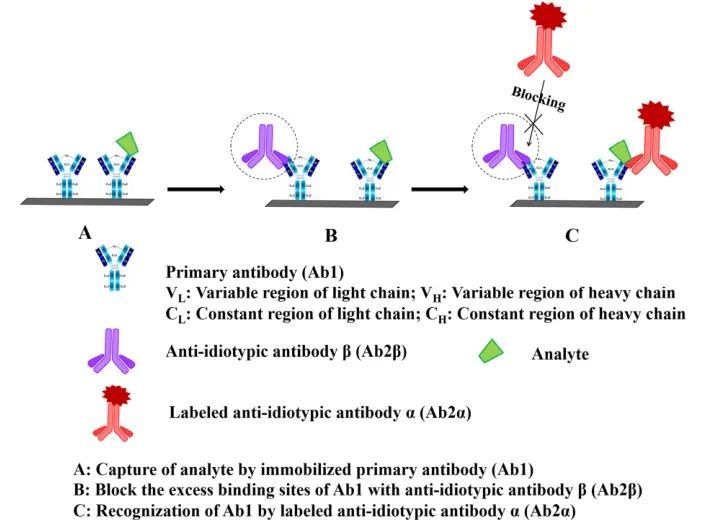
图4 抗独特型抗体非竞争性免疫分析方案
这种类型的AIA-NIA也可称为选择性抗体系统,其中Ab2α作为选择性抗体起作用。Barnard报道了一种新的非竞争性SMC免疫分析方法,将该原理应用于直接测定血清中的雌二醇。两种类型的抗独特型抗体识别特异性一抗(例如,抗雌二醇)的高变区内的不同表位。使用这些匹配的抗体(一抗、α型和β型)已经开发出一种不基于传统的双位点分析来确定抗体占用的方法。该方法具有良好的灵敏度、准确性和与其他竞争性免疫测定方法的可比性。如今,AIA-NIA已应用于不同的小分子分析物,包括雌二醇(LOD:28 pg/mL)、皮质醇(LOD:90 pg =248 fmol)和脱氧镍黄醇等。在开发AIA-NIA方法时,α和β独特型抗体Ab2α和Ab2β配对抗体的生产是第一步,也是最困难的一步。此外,阳性克隆效率很低,抗体同型和筛选复杂,限制了AIA-NIA方法的开发和应用。
4.基于抗免疫复合物抗体的非竞争性免疫分析法(AICA-NIA)
半抗原(如短肽或药物)的免疫分析通常基于竞争有限数量抗体上的结合位点的原则。由于抗原体积小,两个特异性抗体不能同时结合一个半抗原。然而,据报道,含有抗异型抗体的抗血清可以结合免疫复合物。因此,提出了一种基于抗免疫复合物抗体的新方法,即新型抗体与一种抗体/抗原复合物形成后产生的新表位结合。这种新型抗体被称为抗异型抗体,最初由Voss等人提出,这种抗异型抗体特异性地识别抗原/抗体复合物,同时对原始抗原或抗体分子不表现出亲和力。这种性质可用于开发双位点非竞争性ICAs;AICA-NIA的反应原理如下(图5):2)在每个孔中加入样品或标准品,进行抗原抗体结合,形成免疫复合物。3)加入标记物标记好的抗异型抗体(Ab2),与抗原抗体复合物结合。
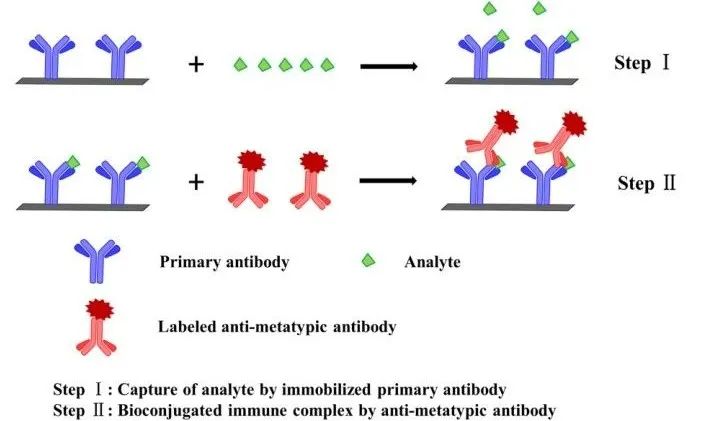
图5 基于非竞争性免疫分析的免疫复合物抗体方案
这种双位点非竞争性SMCs方案被应用于开发血清中地高辛的检测方法。结果表明,该方法简便、快速(培养时间1~10 min)、灵敏度高(LOD 30 ng/L),且不受地高辛结构类似物的干扰。此外,对于血管紧张素II的夹心检测,开发了一种基于免疫复合物抗体的新检测方法。Towbin报道了能够与八肽血管紧张素II形成三元复合物的单克隆抗体对(LOD为1 pg/mL)。在AICA-NIA中,首先也是最重要的是获得抗免疫复合物抗体。制备这些抗体是相当困难和耗时的,通常需要用抗体或分析物抗体复合物进行免疫,由于抗原与抗体结合后免疫复合物的微小变化,这些方法很少成功。此外,考虑到超过85%的抗原和抗体分子的复合物潜在表位最终将有效地嵌入免疫复合物中,因此难以预测复合物结构上有效和可靠的结合位点,免疫复合物不能被准确地识别。为了避免这些问题,噬菌体抗免疫复合物试验(PHAIA)技术被用于抗异型抗体的生产,这可能有利于小分析物的非竞争性分析。在该技术中,噬菌体展示库被用于分析物-抗体免疫复合物的选择。噬菌体克隆用于识别免疫复合物而不是游离抗体,是二级结合试剂。HRP标记的抗噬菌体抗体产生信号,除HRP外,还采用DNA进行噬菌体抗免疫复合物实时PCR (PHAIA-PCR)检测SMCs。Hee-Joo Kim报道了PHAIA技术,其中显示在M13噬菌体表面的短肽环与抗体-分析物复合物特异性结合。编码该肽的噬菌体DNA可通过PCR扩增。这种方法省略了半抗原功能化或DNA模板的生物偶联,同时提高了灵敏度。经验证,PHAIA-PCR比传统PHAIA灵敏度高10倍,并且使用磁珠快速分离反应物的速度更快。在PHAIA技术的基础上,采用AICA-NIA技术对孔雀石绿(MG)、白孔雀石绿(LMG)、氯马松、阿特拉津、除草剂氯马松、3-苯氧基苯甲酸、溴化二苯醚、禾草特、阿特拉津、真菌毒素进行了检测。自主多样化库(ADLib)系统支持PHAIA技术,是生产免疫复合物抗体的一种极好的替代技术。ADLib系统可以从鸡B细胞系DT40显示的免疫球蛋白M (IgM)文库中快速筛选和体外分离抗原特异性单克隆抗体(mAbs)。基于ADLib系统的新应用,开发了抗异型抗体,并应用于血清样本中雌二醇(E2)和25-羟基维生素D[25(OH)D]的检测。E2的LOD为3.13 pg/mL,25(OH)D为2.1 ng/mL。与竞争性ELISA相比,灵敏度显著提高。
5.开放式夹心非竞争性免疫分析(OS-NIA)
OS-NIA是一种新型的非竞争性检测技术,可用于SMCs的非竞争性检测。该方案的优点在于其适用性与靶标分析物的分子量无关。在异相免疫分析中,OS-NIA方法是由Ueda首先提出的。观察到,来自特定抗体可变结构域的自由VH和VL链的结合力较弱;在没有抗原的情况下,VH和VL是分离的。然而,在抗原存在的情况下VH和VL链会在强作用力下结合,抗原作为桥梁,增强了结合的亲和力和稳定性。基于这一现象,设计了OS-NIA步骤。原理如图6所示,具体流程如下:1)将VL链与载体蛋白偶联,固定在ELISA板上。2)非竞争反应添加靶标分析物和标记的VH链。分析物作为“桥梁”,VH和VL具有较强的结合。
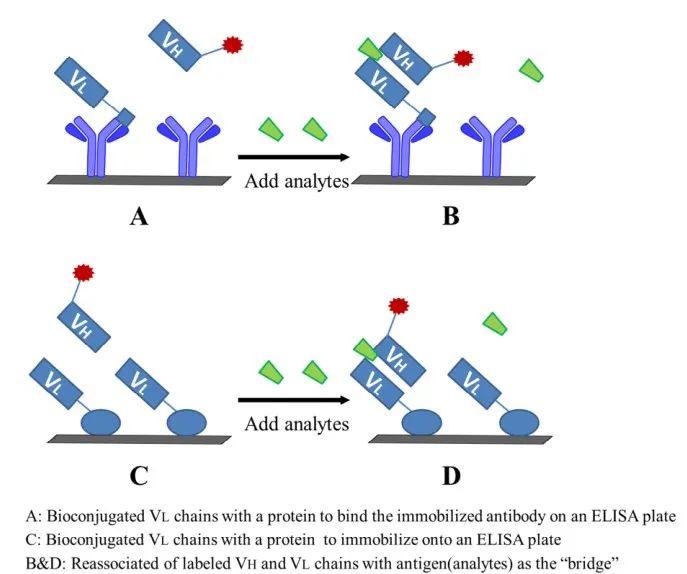
图6 开放式夹心非竞争性免疫分析方案
在Ueda的研究中,描述了基于单区域分离的VL和VH链之间相互作用的免疫分析,在抗原的存在下,这些链重新结合。抗鸡蛋溶菌酶(HEL)抗体HyHEL-10的VL片段固定在微孔板上。样品与M13显示的VH链共孵育,并用过氧化物酶标记的M13抗体进行检测。信号检测与样品中HEL含量成正比,LOD灵敏度为15 ng/mL。此外,Ueda等人为了监测与糖尿病和阿尔茨海默病等几种疾病过程相关的一种重要的氧化生物标志物,13(R,S)-羟基-9(E),11(E)-十八碳二烯酸(13-(E,E)-HODE),在M13噬菌体上显示杂交瘤1213-1产生的抗体的抗原结合片段,并对抗体可变区基因进行分析,其LOD为2.2 nM,而竞争性ELISA为15.6 nM。目前,该方法已成功应用于雌激素真菌毒素玉米赤霉烯酮、贝类毒素、雌二醇、甲状腺激素T4、皮质类固醇、苯甲醛的检测。在另一项研究中,抗体可变区(VH和VL结构域)的抗原依赖性稳定被提出用于半抗原的定量。从4-羟基-3-硝基苯乙酰(NP)抗体中获得了高亲和力突变体VH结构域和VL结构域两个融合蛋白。当这些融合蛋白添加在一起时,在NP存在的情况下实现了再结合,信号的产生与NP浓度直接相关,并且比竞争性免疫分析具有更好的灵敏度。在用于检测玉米赤霉烯酮(ZEA)的OS-NIA中,研究者将ZEA单抗的VH和VL cDNAs克隆到分裂Fv噬菌体pKST2上,结果分别在M13噬菌体p9和p7上显示了VH和VL片段。成功地检测了ZEA,其检出限和检测范围均比同类检测方法更广。OS-NIA方法也可以适用于标记DNA,通过使用重组融合蛋白的免疫聚合酶链反应产生信号。在这个实验中,骨相关疾病的生物标志物,麦芽糖结合蛋白融合VH(MBP-V(H))的抗体识别人骨钙素的c端片段被固定在微孔板上。将同一抗体的链霉亲和素(SA)融合的VL与游离骨钙素一起加入,所有试剂一起孵育。实时PCR检测结果LOD为100 fg/mL。也有一些无标记的OS-NIA方法报道用于检测各种SMC。这是利用场效应检测来自单个抗体可变区域的分离VL和VH链的抗原依赖性链间相互作用引起的内部分子电场变化。将VH链和小抗原双酚A引入固定化VL链可以直接进行电检测。此外,在VL链上加入带负电荷的异硫氰基-EDTA可将检测限改善至1 pM。这种无标签方式可以基于捕获靶标分子直接反应电荷密度的变化。在均相OS-NIA方法中,无需重复孵育和洗涤步骤即可完成反应过程。因此,检测时间可以大幅度缩减。用OS-NIA对抗体可变区进行抗原依赖性结合,用于检测4-羟基-3-硝基苯乙酰(NP)。监测两个融合蛋白的重新结合,一个抗4-羟基-3-硝基苯乙酰(NP)抗体VH融合到β-半胱氨酸N端缺失突变体(VH βα),和VL融合到β-半胱氨酸C端缺失突变体(VL δ ω)。在简单的试剂与样品混合后,观察到抗原(NP)依赖性的酶活性增加。与相应的异相免疫吸附试验相比,灵敏度提高了约1000倍,这可能是由于VH-VL结合的背景值较低利用荧光共振能量转移(FRET)在荧光标记的VH和VL片段之间监测了抗鸡蛋溶菌酶(HEL)抗体HyHEL-10可变区抗原依赖的稳定性。分别用荧光素琥珀酰亚胺酯和罗丹明-X标记VH和VL片段,在冷却的试管中混合,监测加入抗原后荧光光谱的变化。在另一项工作中,两个融合蛋白的重新结合,VH片段连接到β-半乳糖的N端缺失突变体VHδ α,VL片段连接到β -半乳糖的C端缺失突变体VL δ ω,通过两者之间的酶互补来监测。为了优化实验,连接每个融合蛋白的两个结构域的连接臂的长度是不同的;优化后的VH/VL对由于低VH/VL浓度和背景异源二聚体结合而使灵敏度提高了1000倍。这种分析基本上是基于分离的VH和VL链之间的不同相互作用,存在或不存在抗原。这种OS-NIA方法需要构建编码VH和VL蛋白序列的DNA片段。此外,表达和纯化步骤复杂,并不是所有抗体分离的VH/VL在抗原存在时都表现出结合能力增强的特点,这限制了该方法的应用。噬菌体抗体库因其容量大,被认为是制备高亲和力、高特异性抗体的有效技术。在没有抗原的情况下,应用分子定向转化技术减弱VH与VL的结合能力,通过提高信噪比提高灵敏度。
6.基于标记分析物的非竞争性免疫分析法(DLA-NIA)
DLA-NIA是由Giraudi首次提出用于SMC分析物的检测。原理如图7所示:4)最后,标记后的分析物信号强度与分析物浓度呈正相关。
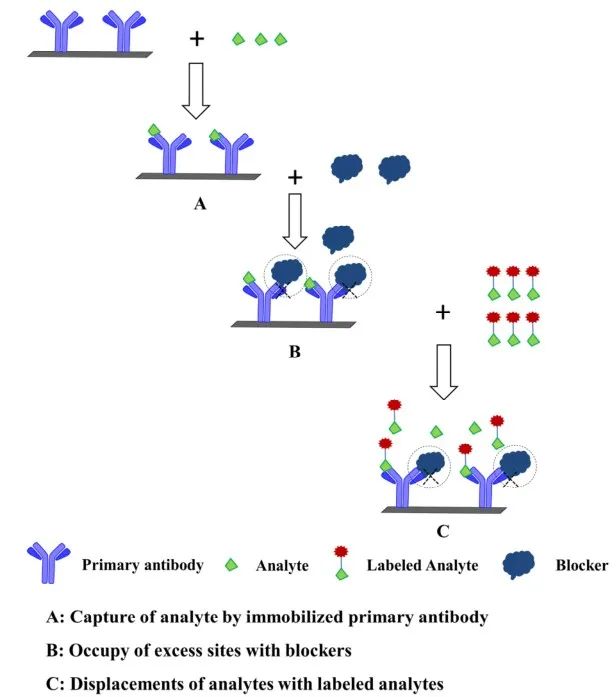
图7 基于非竞争性免疫分析的标记分析物/抗体置换方案
Giraudi的方法基于“多齿配体”(皮质醇-聚(l-赖氨酸)缀合物)的使用,能够阻断未被分析物占据的抗体位点。用酶标记分析物(皮质醇-HRP)替代抗体结合分析物后,直接监测分析物结合位点。观察到的信号与分析物浓度呈直接的线性相关。研究了分析物和多齿配体与特异性抗体之间的相互作用特性,以对皮质醇的非竞争性免疫分析进行初步评估。将非竞争性测定法与在相同条件下使用相同试剂获得的竞争性免疫测定法进行比较。实验结果表明,非竞争性模式的检出限较低(0.15 ng/mL而不是0.72 ng/mL)。针对黄曲霉毒素(AFB1+AFB2+AFG1+AFG2)的检测,本文描述了一种广谱捕获、非竞争性的AFB1多克隆检测抗体检测方法。该方法基于用AFB1蛋白偶联物阻断捕获抗体的游离位点,然后用酶标记的AFB1取代抗体结合的AFs。AFB1-HRP偶联物对弱结合AFB1同源物的取代速度比AFB1快,因此,交叉反应物的测定信号更高,几乎与AFB1浓度线性相关。利用酪蛋白、卵清蛋白和牛血清白蛋白等不同的蛋白质制备AFB1偶联物,并研究了它们的结合效率,本方法对AFs的检出限为5 pg/孔(0.1µg/L)。Lates等人报道了一种新的检测赭曲霉毒素A (OTA)的方法,基于其脱氯类似物赭曲霉毒素B (OTB)在置换免疫分析法中的使用。将OTB固定在微孔玻璃微珠上,结合抗OTA抗体,以抗IgG抗体过氧化物酶偶联物为标记。通过这种方法,获得了一种初始的生物传感材料。当这种材料与OTA一起孵育时,毒素会与OTB竞争抗OTA抗体的结合位点,并将抗体标记的过氧化物酶复合物释放到溶液中。这种新开发的RLAB-NIA方法与SMC检测具有相似的检测限和检测时间。综上所述,本文全面回顾了目前对SMCs的新型非竞争性免疫测定方法的认识。虽然传统的竞争性检测方法可以用于SMC检测,但灵敏度可能不足以适用于特定的应用。借助新颖的非竞争性设计,能够以更高的灵敏度检测SMCs。本文讨论了6种不同反应设计(BA-NIA, SPIE-NIA,AIA-NIA,AICA-NIA,OS-NIA和DLA-NIA)的非竞争性研究,重点是SMCs的分析和高灵敏度检测。值得注意的是,最近的文献注重方法的灵敏度。一些污染性靶标SMCs通常处于复杂的基质中。去除干扰后,SMCs检测的灵敏度和特异性显得尤为重要。非竞争性免疫分析可能被广泛应用于不同的多通路和高通量的靶标分析物筛选。在未来,将应用新的和改进的技术来增强非竞争性免疫化学检测SMCs的新反应模式。8188www威尼斯深耕体外诊断原料自主研发,坚持自主创新,拥有成熟的体外诊断及生命科学领域上游关键原材料研究与生产平台,包括小分子定向偶联技术、抗体研发与生产、蛋白质工程技术、酶分子工程技术、核酸合成与修饰、引物探针合成、基因合成与测序等。核心产品涵盖POCT系列、生化系列、化学发光系列,其中治疗药物浓度检测(TDM)系列为特色创新产品。欢迎关注。